超低溫保存中的氧化應激和細胞凋亡
超低溫保存中的氧化應激和細胞凋亡
徐 瑾 劉 芊 李秉玲 劉 燕*
(北京林業大學園林學院, G家花卉工程技術研究中心, 北京 100083)
摘要 作為一門廣泛應用于醫學、水產養殖和瀕危物種保護等*域的生物技術, 超低溫保存已成為近年來低溫生物學的研究熱點之一。但到目前為止, 與超低溫保存相關的機理并未得到全面的闡釋, 從而使超低溫保存技術在應用上受到多方面的限制。該文對近二十年來超低溫保存中與氧化應激和細胞凋亡兩大生理現象相關的研究做出綜述, 以期為推進超低溫保存技術的進步提供理論依據。
關鍵詞 超低溫保存; 氧化應激; 細胞凋亡; 細胞膜
Oxidative Stress and Apoptosis with Cryopreservation
Xu Jin, Liu Qian, Li Bingling, Liu Yan*
(College of Landscape Architecture, Beijing Forestry University, Beijing 100083, China; National Floriculture Engineering Research Center, Beijing 100083, China)
Abstract Cryopreservation, as a widely used biotechnology in fields such as medicine, aquaculture and endangered species protection in recent years, has become one of the research focuses in cryobiology. However, many of the molecular and biochemical mechanisms involved in this process are poorly understood, which restricts the application of cryopreservation in more biological materials. This paper reviewed the researches about oxidative stress and apoptosis with cryopreservation in the last two decades to provide a theoretical basis for promoting advances in cryopreservation.
Key words cryopreservation; oxidative stress; apoptosis; cell membrane

接受日期
徐 瑾 劉 芊 李秉玲 劉 燕*
(北京林業大學園林學院, G家花卉工程技術研究中心, 北京 100083)
摘要 作為一門廣泛應用于醫學、水產養殖和瀕危物種保護等*域的生物技術, 超低溫保存已成為近年來低溫生物學的研究熱點之一。但到目前為止, 與超低溫保存相關的機理并未得到全面的闡釋, 從而使超低溫保存技術在應用上受到多方面的限制。該文對近二十年來超低溫保存中與氧化應激和細胞凋亡兩大生理現象相關的研究做出綜述, 以期為推進超低溫保存技術的進步提供理論依據。
關鍵詞 超低溫保存; 氧化應激; 細胞凋亡; 細胞膜
Oxidative Stress and Apoptosis with Cryopreservation
Xu Jin, Liu Qian, Li Bingling, Liu Yan*
(College of Landscape Architecture, Beijing Forestry University, Beijing 100083, China; National Floriculture Engineering Research Center, Beijing 100083, China)
Abstract Cryopreservation, as a widely used biotechnology in fields such as medicine, aquaculture and endangered species protection in recent years, has become one of the research focuses in cryobiology. However, many of the molecular and biochemical mechanisms involved in this process are poorly understood, which restricts the application of cryopreservation in more biological materials. This paper reviewed the researches about oxidative stress and apoptosis with cryopreservation in the last two decades to provide a theoretical basis for promoting advances in cryopreservation.
Key words cryopreservation; oxidative stress; apoptosis; cell membrane
接受日期
G家自然科學基金(批準號: 30972411)資助的課題
*通訊作者。Tel: 010-62336062, E-mail: chbly@sohu.com
Received: November 3, 2012 Accepted: January 5, 2013
This work was supported by the National Natural Science Foundation of China (Grant No.30972411)
*Corresponding author. Tel: +86-10-62336062, E-mail: chbly@sohu.com
超低溫保存(cryopreservation)是指將生物材料活體, 采取一定的技術, 存入–80 ℃以下的低溫保存(通常為液氮–196 ℃), 需要時采取一定的方法使之回到常溫并正常生長的一整套生物技術。由于在醫學、農業、畜牧業及食品等相關*域有著廣泛的應用前景, 超低溫保存已成為近年來低溫生物學的研究熱點之一[1]。近年來, 超低溫保存的技術研究已趨于成熟, 除了基于低溫脫水的傳統的超低溫保存技術外, 新興的基于細胞內部溶質玻璃化的超低溫保存技術的發展, 極大地擴充了超低溫保存的應用范圍[2]。超低溫保存技術的發展依賴于其機制的解答, 而機制的解答也會起到指導超低溫保存技術發展的作用。但是, 就目前的現狀而言, 超低溫保存的機制研究相對滯后, 這也在一定程度上限制了超低溫保存技術應用范圍的進一步擴大。
近年來的研究發現, 在超低溫保存中往往伴隨著氧化應激和細胞凋亡兩大生理現象, 這些現象是否與超低溫保存密切相關, 是否會影響超低溫保存的效果, 是否可以作為改進超低溫保存技術的依據, 這些問題也逐漸得到了研究者的關注。本文對近二十年來超低溫保存中與氧化應激和細胞凋亡兩大生理現象相關的研究做出綜述, 以期為推進超低溫保存技術的進步提供理論依據。
1 超低溫保存中的氧化應激現象
氧化應激是指由于活性氧(reactive oxygen species, ROS)過度產生和抗氧化防御機制減弱, 導致活性氧的生成和清除之間的平衡失調, 過量的活性氧引起分子、細胞和機體的損傷[3-7]。諸多的研究發現, 超低溫保存往往伴隨著生物材料中活性氧水平的升高, 而過多的活性氧引起的氧化應激是導致生物材料超低溫保存損傷的重要原因之一。理論表明, 當活性氧的生成量大于細胞的抗氧化防御系統水平時, 過多的活性氧就會攻擊脂質、蛋白質或核酸等大分子, 通過去除電子的方式, 促使其結構的修改和功能的改變, 從而導致脂質的過氧化、蛋白質的變性以及DNA或 RNA的損傷[8-10]。Baumber[11]對馬精子的超低溫保存研究發現, 高水平活性氧的生成會增加DNA的片段化和減少谷胱甘肽的生成量, 并認為活性氧可能與精子獲能的信號通路相關。這與Meseguer等[12]的發現存在一定的一致性——谷胱甘肽過氧化物酶1和4的表達水平及活性、谷胱甘肽濃度與人類精子超低溫保存后的恢復速率相關,。Li等[13]同樣在人類精子的超低溫保存中發現, 保存后活性氧的生成量顯著上升, 并且與凍融后精子的生存力和運動性下降等變化呈現出相關性, 因此認為超低溫保存后精子質量的下降可能是由氧化應激所造成的。Zribi等[14]在人類精子的超低溫保存中也發現了保存后精子的DNA片段化和氧化率顯著增加的現象, 但并未對其產生機制做出解釋。Thomson等[15]以8-羥化脫氧鳥苷(8-OHdG)作為生物標記, 證明了超低溫保存引起的人類精子DNA片段化與氧化應激相關。
生物材料中活性氧的種類包括了激活的單電子氧(1O2)、超氧陰離子自由基(·O2–)、過氧化氫(H2O2)和羥基自由基(·OH)等[16]。目前的研究顯示, 與超低溫保存相關的氧化應激可能是由羥基自由基所主導的。Fang等[16]在研究中發現, 超低溫保存后伴隨著可可體細胞胚的恢復, 羥基自由基產生的揮發性碳氫化合物——甲烷, 呈現出一定的周期性變化規律。更確鑿的證據來自于Góes等[10]的研究, 他們將超低溫保存后的山羊精子培養在4種不同的活性氧誘導機制下(分別產生激活的單電子氧、超氧陰離子自由基、過氧化氫和羥基自由基), 精子對羥基自由基顯示出了高敏感性。
為了減少或消除氧化應激的影響, 抗氧化劑在超低溫保存中得到了廣泛的應用。抗氧化劑可以轉換活性氧, 防止其過剩, 從而**大限度地提高超低溫保存后細胞的存活率[17]。在眾多的抗氧化劑中, 過氧化氫酶經常作為冷凍和熔融過程中的添加劑使用。研究表明, 添加過氧化氫酶可以顯著減少超低溫保存后人類精子[13]和馬精子[11]的活性氧的生成量, 提高家貓精子的運動性和前向性[8], 并改善人類造血干細胞的粘附性和與遷移有關的屬性等[18]。此外, 過氧化物歧化酶[8]、依達拉奉[19]、維他命E、維他命C、谷胱甘肽、硫辛酸、甜菜堿[9]、抗壞血酸[13]、蛋氨酸、肌醇、肉堿[20]等物質也被作為抗氧化劑應用于超低溫保存中。**新的研究還顯示, 精漿對于解凍后馬精子[11]和山羊精子[10]的恢復更為有效: 而血小板裂解物對超低溫保存后人類肝臟細胞代謝功能的恢復更為有效[21]。這可能同樣是與精漿和血小板裂解物中含有抗氧化性的物質相關。
此外, 針對細胞膜的研究顯示, 超低溫保存會造成細胞膜的大范圍破壞, 因此往往將細胞膜的完整性作為成功的超低溫保存的**低標準[22]。如前所述, 氧化應激是造成超低溫保存中生物材料損傷的重要原因之一。活性氧很容易氧化膜脂上的不飽和脂肪酸。脂質的過氧化一方面改變了細胞膜的結構和功能, 例如通透性的升高, 另一方面它會導致二次脂質過氧化產物如醛的生成, 而醛分解后的丙二醛(MDA)又會與蛋白質、酶類和DNA鏈接, 進一步導致潛在的誘變[9, 16, 17]。
Martinez等[23]在甘蔗胚性愈傷組織超低溫保存后的第2天觀察到了電導率的升高。尚曉倩[24]在芍藥花粉的超低溫保存中觀察到電導率隨保存時間延長持續上升: 而李廣清[25]在山茶花粉的超低溫保存中發現花粉電導率是前期升高, 后期有出現下降趨勢, 但仍高于對照。這些研究都說明超低溫保存確實在一定程度上對細胞膜造成了損傷, 從而導致了細胞外電解質滲透液的增加。除了使用電導率作為細胞膜通透性的參數外, 脂質過氧化的產物丙二醛(MDA)也被用來作為檢驗超低溫保存效果的指標。超低溫保存后, 山茶花粉[25]、蠟梅花粉[26]、木薯莖尖[27]、羅氏沼蝦胚胎[28]、留蘭香莖尖[29]等的MDA含量均顯著升高。超低溫保存中氧化應激及外源抗氧化劑關系的研究進展見圖1。
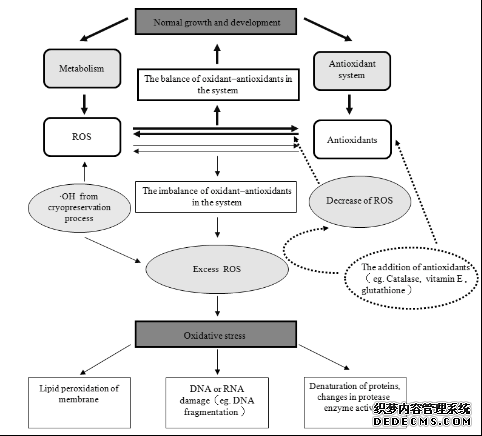
圖1 超低溫保存中氧化應激及外源抗氧化劑作用
Fig.1 Effect of antioxidants to the pro-oxidant/antioxidant balance in the cryopreservation
除了以上脂質過氧化的間接證據外, 研究者還證明了超低溫保存對細胞膜脂類成分變化的直接影響。Blesbois等[30]發現超低溫保存導致火雞和珍珠雞精子的細胞膜膽固醇/磷脂的比例顯著下降, 并認為這種變化降低了細胞膜的流動性。Chakrabarty等[31]在山羊精子的超低溫保存中發現, 總脂及其組成成分的中性脂肪、糖脂和磷脂在超低溫保存后下降明顯, 其中與磷脂相關的不飽和脂肪酸比例變小, 而飽和脂肪酸比例上升, 因而認為山羊精子應對超低溫損傷的主要機制是通過優先脫落細胞膜中親水性的脂質成分而增加細胞膜的疏水性進行的。Odintsova等[32]對海洋無脊椎動物幼蟲細胞的研究顯示, 超低溫保存極大地影響了細胞膜脂肪酸的飽和度、單烯度和多烯度, 并且這種變化因保存的細胞來源和使用的冷凍保護劑而存在差異。
鑒于以上研究, 相應的細胞膜保護措施也被應用于超低溫保存中, 其中通過一定的方式來增加膽固醇和不飽和脂肪酸的含量是采取的主要方式。已證明, 外援膽固醇的添加可以顯著改善牛精子[33]和馬精子[34]超低溫保存后的存活率: 而Ω-3脂肪酸可以顯著提高超低溫保存后不飽和脂肪酸的含量[35]。此外, 還有研究發現, 蔗糖的預培養可以使香蕉懸浮細胞超低溫保存后豆甾醇/甾醇的比例, 總脂肪酸中的中性脂質、糖脂和鞘脂的成分以及游離脂肪酸酸含量顯著增高, 并使中性脂肪的雙鍵指數增加以及糖脂和鞘脂、磷脂和游離脂肪酸的雙鍵的減少, 并提高了超低溫保存后的存活率[36]。而利用毛猴素進行化學去脂, 可以顯著提高貓胚胎超低溫保存后的存活率、桑椹胚和胚泡的形成率[37]。這些保護措施可能都與改變細胞膜脂類成分的含量相關。
2 超低溫保存中的細胞凋亡現象
超低溫保存造成的細胞死亡主要有以下三種類型: 細胞破裂(與冰晶生成有關)、細胞壞死和細胞凋亡[38]。部分研究發現, 超低溫保存造成的細胞死亡具有遲發性, 進一步研究遲發性死亡的背后機制顯示, 這種死亡主要是由細胞壞死和細胞凋亡這兩種途徑所造成的[39]。其中, 區別于細胞壞死的被動過程, 細胞凋亡作為一種與能量相關的, 由基因控制的細胞**、有序的死亡方式, 得到了超低溫保存機制研究者的廣泛關注。細胞凋亡通常會采用半胱氨酸蛋白酶活力、磷脂酰絲氨酸的外化、線粒體膜電位的改變和DNA片段化等參數進行檢測[40]。Paasch等[41]比較了超低溫保存對人類精子細胞凋亡參數的影響, 發現超低溫保存后, 半胱氨酸蛋白酶-3、-8和-9的活性顯著上升, 線粒體膜電位下降, 但DNA片段不存在顯著變化。Martin等[42-43]同樣在超低溫保存后的牛精子中發現線粒體膜電位的降低、半胱氨酸蛋白酶活性和細胞膜通透性升高等現象, 并檢測到了細胞色素C和凋亡誘導因子這兩種伴隨細胞凋亡的蛋白的產生, 但沒有發現DNA片段化和細胞核濃縮的顯著變化。Vogel[44]通過免疫印跡技術比較了人類真皮的成纖維細胞中線粒體蛋白質Bcl-XL和Bax的比值(這兩種蛋白的比值代表了細胞凋亡正向和負向的比例), 發現在超低溫保存復溫后比值略有升高, 在之后的6小時和12小時顯著上升, 直到24小時才恢復到與對照相當的水平。Liu等[45]在比較超低溫保存前后的小鼠卵巢卵泡的基因組時, 發現超低溫保存誘導了凋亡基因Fas和Fas配體的表達。Park等[46]同樣證明了凍融過程引起了牛囊胚細胞中與凋亡相關的生存素、Fas、熱休克蛋白70和半胱氨酸蛋白酶-3基因表達量的增加。
以上研究在證明超低溫保存與細胞凋亡的相關性之外, 也為如何減輕或消除細胞凋亡的影響指明了道路。半胱氨酸蛋白酶抑制劑已被證明在豬肝細胞超低溫保存中降低了半胱氨酸蛋白酶-3的活性、減少線粒體中細胞色素C的釋放, 減慢線粒體膜電位的下降速度, 并使肝細胞活力的功能指標——白蛋白產量、地西泮的代謝和尿素產量顯著增加[47]。而在大鼠的肝細胞超低溫保存中, 添加半胱氨酸蛋白酶抑制劑則顯著改善了復溫后6小時和24小時的肝細胞的分化能力和功能[48]。
氧化應激和細胞凋亡作為近年來超低溫保存中生理現象的兩大研究熱點, 其本身也存在著千絲萬縷的聯系。研究表明, 超低溫保存中出現的氧化應激不僅可以直接造成細胞損傷, 也可能誘導了細胞凋亡, 如活性氧活化核轉錄因子NF-KB(nuclear factor-Kappa B, NF-kB), 導致細胞凋亡; 或通過作用于線粒體介導細胞凋亡; 活性氧導致DNA損傷, 激活P53, 誘導細胞凋亡以及ROS激活SAPK通路介導細胞凋亡等[49]。
圖2所示線粒體產生的活性氧介導的細胞凋亡, 可以在一定程度上反映超低溫保存中細胞凋亡與氧化應激的關系。
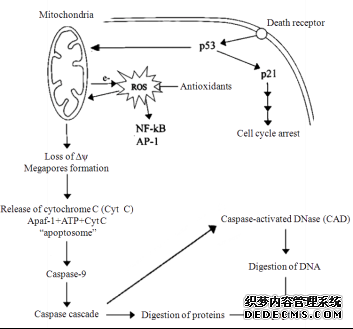
圖2 由線粒體產生的活性氧介導的細胞凋亡示意圖(根據參考文獻[50]修改)
Fig.2 Schematic representation of apoptosis which is mediated by ROS generated by mitochondria(modified from reference [50])
3 結語和展望
超低溫保存中有關氧化應激和細胞凋亡兩大生理現象的研究還處于起步階段, 本質的揭示尚需要大量的實驗支持。對超低溫保存中氧化應激和細胞凋亡這兩大生理現象廣泛和深入研究, 不僅對揭示超低溫保存機制有重要的理論意義, 也將為超低溫保存技術發展提供一條新的思路。圍繞該研究方向, 未來的超低溫保存研究將集中在超低溫保存技術中探索更多的抗氧化劑(包括酶類和非酶類)的使用效果, 從而開發新型的保護劑; 超低溫保存的技術策略也會更多通過防止細胞膜氧化, 而不是僅僅關注冰晶對細胞膜的傷害展開; 超低溫引起細胞凋亡的信號途徑及其阻斷技術也會得到深入的研究, 從而提高超低溫保存材料的成活率。
參考文獻 (references)
1 李秉玲. 芍藥屬植物超低溫保存花粉的差異表達蛋白質研究及花粉庫的建立(博士論文). 北京林業大學(Li Bingling. Studies on differentially expressed protein of pollen cryopreservation and cryobank construction of Paeonia spp. Beijing Forestry University) 2010.
2 Engelmann F. Plant cryopreservation: Progress and prospects. In Vitro Cell Dev Biol Plant 2004; 40(5): 427-33.
3 武 強, 劉鄭榮. 慢性腎功能不全病人中的氧化應激現象觀察. 實用醫學雜志(Wu Qiang, Liu Zhengrong. The Journal of Practical Medicin) 2004(10): 1160-1.
4 龔 偉, 唐 政. 氧化應激和抗氧化治療在慢性腎功能衰竭和高血壓中的作用. 腎臟病與透析腎移植雜志(Gong Wei, Tang Zheng. Chinese Journal of Nephrology, Dialysis & Transplantation) 2005(3): 254-8.
5 Sohal RS, Weindruch R. Oxidative stress, caloric restriction, and aging. Science 1996; 273(5271): 59-63.
6 Beatty S, Koh H, Phil M, Henson D, Boulton M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Surv Ophthalmol 2000; 45(2): 115-34.
7 Sies H. Oxidative stress: Oxidants and antioxidants. Exp Physiol 1997; 82(2): 291-5.
8 Elkins EC. Cryopreservation of domestic cat (felis catus) epididymal spermatozoa in the presence of antioxidants. The American University, 2006.
9 Uchendu EE. Cryopreservation of shoot tips: Antioxidant investigations with Rubus and protocols for Mentha and Vaccinium. Oregon State University, 2009.
10 Goes PA, Nichi M, Silva RO, Perez EG, Dalmazzo A, Gurgel JR, et al. Influence of cryopreservation on the susceptibility of goat sperm against different reactive oxygen species. Reprod Fertil Dev 2011; 23(1): 143.
11 Baumber J. Reactive oxygen species and. Equine sperm function. University of California, 2003.
12 Meseguer M, Garrido N, Simon C, Pellicer A, Remohi J. Concentration of glutathione and expression of glutathione peroxidases 1 and 4 in fresh sperm provide a forecast of the outcome of cryopreservation of human spermatozoa. J Androl 2004; 25(5): 773-80.
13 Li Z, Lin Q, Liu R, Xiao W, Liu W. Protective effects of ascorbate and catalase on human spermatozoa during cryopreservation. J Androl 2010; 31(5): 437-44.
14 Zribi N, Feki Chakroun N, El Euch H, Gargouri J, Bahloul A, Ammar Keskes L. Effects of cryopreservation on human sperm deoxyribonucleic acid integrity. Fertil Steril 2010; 3(1): 159-66.
15 Thomson LK, Fleming SD, Aitken RJ, De Iuliis GN, Zieschang JA, Clark AM. Cryopreservation-induced human sperm DNA damage is predominantly mediated by oxidative stress rather than apoptosis. Hum Reprod 2009; 24(9): 2061-70.
16 Fang J, Wetten A, Johnston J. Headspace volatile markers for sensitivity of cocoa (Theobroma cacao L.) somatic embryos to cryopreservation. Plant Cell Rep 2008; 27(3): 453-61.
17 Luz HKM, Wanderley LS, Faustino LR, da Silva CMG, de Figueiredo JR, Rodrigues APR. Role of antioxidants agents in germ cells and embryos cryopreservation. Acta Sci Vet 2011; 39(2): 956.
18 Sasnoor LM, Kale VP, Limaye LS. A combination of catalase and trehalose as additives to conventional freezing medium results in improved cryoprotection of human hematopoietic cells with reference to in vitro migration and adhesion properties. Transfusion 2005; 45(4): 622-33.
19 段永壯, 鐘世鎮, **增濤, 徐達傳, 丁自海, 付慶林, 等. 依達拉奉對深低溫凍存大鼠斷肢再植后缺血再灌注損傷骨骼肌細胞膜及線粒體的保護效應(英文). 中G組織工程研究與臨床康復(Duan Yongzhuang, Zhong Shizhen, Wang Zengtao, Xu Dachuan, Ding Zihai, Fu Qinglin, et al. Protective influence of edaravone on cellular membrane and mitochondria of replanted rat extremities following ischemia/reperfusion injury due to cryopreservation and rewarming. Journal of Clinical Rehabilitative Tissue Engineering Research) 2007; 11(25): 5032-5.
20 Bucak MN, Tuncer PB, Sariozkan S, Baspinar N, Taspinar M, Coyan K. Effects of antioxidants on post-thawed bovine sperm and oxidative stress parameters: Antioxidants protect DNA integrity against cryodamage. Cryobiology 2010; 61(3): 248-53.
21 Tolosa L, Bonora-Centelles A, Teresa Donato M, Mirabet V, Pareja E, Negro A. Influence of platelet lysate on the recovery and metabolic performance of cryopreserved human hepatocytes upon thawing. Transplantation 2011; 91(12): 1340-6.
22 Tchir J, Acker JP. Mitochondria and membrane cryoinjury in micropatterned cells: Effects of cell-cell interactions. Cryobiology 2010; 61(1): 100-7.
23 Martinez-Montero ME, Mora N, Quinones J, Gonzalez-Arnao MT, Engelmann F, Lorenzo JC. Effect of cryopreservation on the structural and functional integrity of cell membranes of sugarcane (Saccharum sp.) embryogenic calluses. Cryo Letters 2002; 23(4): 237-44.
24 尚曉倩. 芍藥花粉超低溫保存研究(碩士論文). 北京林業大學(Shang Xiaoqian. Sutdies on cyropresevration of peony pollen. Beijing Forestry University), 2005.
25 李廣清. 山茶花粉超低溫保存研究(碩士論文). 北京林業大學(Li Guangqing. Sutdies on cyropresevration of Camellia pollen. Beijing Forestry University), 2005.
26 陳 珊. 蠟梅屬植物花粉低溫及超低溫保存研究(碩士論文). 華中農業大學(Chen Shan. Studies on pollen cold storage and cryopreservation of Chimonanthus. Central China Agricultural University), 2005.
27 陳志林. 木薯種質超低溫保存及其再生植株遺傳穩定性的研究(碩士論文). 華南熱帶農業大學(Chen Zhilin. Studies on Cassava germplasm cryopreservation and genetic stability of its regenerated plant. South China University of Tropical Agriculture), 2007.
28 黃曉榮, 章龍珍, 莊 平, 江 琪, 姚志峰, 劉鑒毅, 等. 超低溫保存對羅氏沼蝦胚胎幾種酶活性的影響. 海洋漁業(Huang Xiaorong, Zhang Longzhen, Zhuang Ping, Jiang Qi, Yao Zhifeng, Liu Jianyi, et al. Effects of cryopreservation on enzyme activity in embryo of Macrobrachium rosenbergii. Marine fisheries) 2010; 2: 166-71.
29 邵 麗. 留蘭香種質材料的超低溫保存及遺傳變異分析(碩士論文). 河南大學(Shao Li. Cryopreservation of Mentha Spicata L. germplasm and analysis of genetic variation. Henan University), 2011.
30 Blesbois E, Grasseau I, Seigneurin F. Membrane fluidity and the ability of domestic bird spermatozoa to survive cryopreservation. Reproduction 2005; 129(3): 371-8.
31 Chakrabarty J, Banerjee D, Pal D, De J, Ghosh A, Majumder GC. Shedding off specific lipid constituents from sperm cell membrane during cryopreservation. Cryobiology 2007; 54(1): 27-35.
32 Odintsova NA, Boroda AV, Velansky PV, Kostetsky EY. The fatty acid profile changes in marine invertebrate larval cells during cryopreservation. Cryobiology 2009; 59(3): 335-43.
33 Purdy PH. Cholesterol supplementation of bovine sperm. Colorado State University, 2003.
34 Moore AI. Effects of cholesterol supplementation on the cryosurvival of equine spermatozoa. Colorado State University, 2005.
35 Harris MA. The influence of omega-3 fatty acid supplementation on stallion spermatozoa survival following short- and long-term preservation. The University of Arizona, 2005.
36 Zhu G, Geuns JM, Dussert S, Swennen R, Panis B. Change in sugar, sterol and fatty acid composition in banana meristems caused by sucrose-induced acclimation and its effects on cryopreservation. Physiol Plant 2006; 128(1): 80-94.
37 Tharasanit T, Techakumphu M. The effect of chemical delipidation on cryopreservability of cat embryos. Reprod Fertil Dev 2011; 23(1): 153.
38 Mukherjee IN. A rational design approach for the cryopreservation of natural and engineered tissues. Georgia Institute of Technology, 2008.
39 Robilotto AT. Calpain activation following cryopreservation: an initial investigation into their roles in cell death and cell adhesion. State University of New York at Binghamton, 2005.
40 Said TM, Gaglani A, Agarwal A. Implication of apoptosis in sperm cryoinjury. Reprod Biomed Online 2010; 21(4): 456-62.
41 Paasch U, Sharma RK, Gupta AK, Grunewald S, Mascha EJ, Thomas AJ, et al. Cryopreservation and thawing is associated with varying extent of activation of apoptotic machinery in subsets of ejaculated human spermatozoal. Biol Reprod 2004; 71(6): 1828-37.
42 Martin G, Sabido O, Durand P, Levy R. Cryopreservation induces an apoptosis-like mechanism in bull sperm. Biol Reprod 2004; 71(1): 28-37.
43 Martin G, Cagnon N, Sabido O, Sion B, Grizard G, Durand P, et al. Kinetics of occurrence of some features of apoptosis during the cryopreservation process of bovine spermatozoa. Hum Reprod 2007; 22(2): 380-8.
44 Vogel MJ. Proteomic profiling following cryopreservation. State University of New York at Binghamton, 2005.
45 Liu HC, He ZM, Rosenwaks Z. Mouse ovarian tissue cryopreservation has only a minor effect on in vitro follicular maturation and gene expression. J Assist Reprod Genet 2003; 20(10): 421-31.
46 Park SY, Kim EY, Cui XS, Tae FC, Lee WD, Kim NH, et al. Increase in DNA fragmentation and apoptosis-related gene expression in frozen-thawed bovine blastocysts. Zygote 2006; 14(2): 125-31.
47 Matsushita T, Yagi T, Hardin JA, Cragun JD, Crow FW, Bergen HR, et al. Apoptotic cell death and function of cryopreserved porcine hepatocytes in a bioartificial liver. Cell Transpl 2003; 12(2): 109-21.
48 Fujita R, Hui T, Chelly M, Demetriou AA. The effect of antioxidants and a caspase inhibitor on cryopreserved rat hepatocytes. Cell Transplant 2005; 14(6): 391-6.
49 褚啟龍. 氧化應激與細胞凋亡關系的研究進展. 衛生研究(Chu Qilong. Research progress on oxidative stress and apoptosis. Journal of Hygiene Research) 2003; 3: 276-79.
50 Salganik RI. The benefits and hazards of antioxidants: controlling apoptosis and other protective mechanisms in cancer patients and the human population. J Am Coll Nutr 2001; 20(5 Suppl): 464S-72S, 473S-5S.
- 上一篇:超低溫冰箱操作指南
- 下一篇:超低溫金槍魚產品加工流程及基本產品介紹






